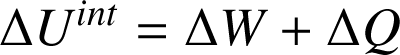Si dans le cas le plus général, l'énergie mécanique est non conservée, peut-on introduire un nouveau concept de sorte à exprimer un principe général de conservation de l'énergie ? C'est la démarche qui a mené au premier principe de thermodynamique (L2).
Définition :
En thermodynamique, on définit le système
 que l'on étudie. Ce système est séparé du monde extérieur par une surface limite (réelle ou imaginaire). Il existe trois types de système : isolé, fermé et ouvert (voir schéma). L'Univers est un grand système isolé.
que l'on étudie. Ce système est séparé du monde extérieur par une surface limite (réelle ou imaginaire). Il existe trois types de système : isolé, fermé et ouvert (voir schéma). L'Univers est un grand système isolé.
|  S isolé |
|  S fermé |
|  S ouvert |
Raisonnons sur un système
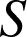 .
.
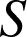 peut avoir un mouvement d'ensemble, donc une énergie cinétique lui est associée. S'il subit des forces extérieures, on lui associera – dans la plupart des cas – une énergie potentielle. Ces deux contributions sont macroscopiques et décrivent
peut avoir un mouvement d'ensemble, donc une énergie cinétique lui est associée. S'il subit des forces extérieures, on lui associera – dans la plupart des cas – une énergie potentielle. Ces deux contributions sont macroscopiques et décrivent
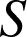 par rapport au monde extérieur.
par rapport au monde extérieur.
Définition :
Toutefois
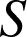 n'est jamais constitué d'un unique point matériel et il faut prendre en compte des contributions microscopiques, internes au système. Celles-ci sont à nouveau d'ordre cinétique ou bien résultent d'interactions plus fondamentales mais difficiles à modéliser. On appelle énergie interne
n'est jamais constitué d'un unique point matériel et il faut prendre en compte des contributions microscopiques, internes au système. Celles-ci sont à nouveau d'ordre cinétique ou bien résultent d'interactions plus fondamentales mais difficiles à modéliser. On appelle énergie interne
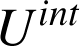 les contributions internes au système.
les contributions internes au système.
Définition :
Lorsque le système est isolé (pas d'interaction, donc pas d'échange d'énergie avec le monde extérieur) et au repos (énergie cinétique globale nulle), l'énergie du système est égale à l'énergie interne. Dans le cas contraire (c'est le cas général), on définit l'énergie totale
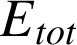 du système comme la somme de ces contributions :
du système comme la somme de ces contributions :
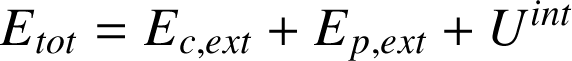
Il existe des transformations énergétiques : l'énergie mécanique peut ainsi se transformer en énergie thermique. Inversement un apport d'énergie thermique peut conduire à un mouvement mécanique. Aussi, depuis qu'Einstein a montré l'équivalence entre matière et énergie
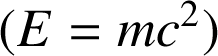 , nous comprenons qu'un processus de fission spontanée donne lieu à un dégagement d'énergie thermique.
, nous comprenons qu'un processus de fission spontanée donne lieu à un dégagement d'énergie thermique.
Fondamental :
Le premier principe de la thermodynamique énonce que l'énergie totale d'un système isolé est constante. Lorsque le système n'est pas isolé, alors la variation de l'énergie totale du système est égale à la somme des travaux
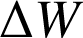 et transferts thermiques
et transferts thermiques
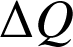 qu'il reçoit/fournit :
qu'il reçoit/fournit :
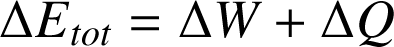
Cette variation d'énergie totale sera de signe contraire dans le monde extérieur, de sorte à ce que l'énergie totale de l'Univers soit constante.
Remarque :
Il est parfois d'usage (par exemple en chimie) de ne pas considérer les contributions macroscopiques (qualifiée d'externes) de l'énergie car leurs variations sont souvent négligeables. Dans ce cas, la variation d'énergie cinétique du système s'écrit